اهمیت مدار پاداش مغزی و نقاط داغ در اعتیاد
اهمیت مدار پاداش مغزی و نقاط داغ در اعتیاد
از آنجا که انسان در یک محیط پیچیده زندگی می کند ، لازم است محرک های مختلف را طبقه بندی کرده و آنها را در گروه های مختلف دسته بندی کند. به طور خاص ، برخی از محرک ها برای زنده ماندن مورد نیاز هستند (غذا ، آب ، جفت گیری ، و غیره) ، در حالی که برخی دیگر خنثی یا مضر هستند.
این توانایی در انتخاب محرکهایی که برای بقای ما مورد نیاز است فقط مختص انسانها نیست بلکه یک ویژگی کلی ذاتی همه گونه های جانوری است. توانایی ما در شناخت محرک های “مثبت” برای کارآمد بودن؛ نیاز به یک سیستم شناسایی سریع دارد.
به عنوان مثال ، در مورد محرک های غذایی ، ما منتظر نمی مانیم تا هضم کامل شود و کالری ذخیره شود تا تشخیص دهیم “محرک غذایی” مثبت است. در مورد جفت گیری جنسی ، ما منتظر نمی مانیم فرزندان متولد شود تا تشخیص دهیم “رفتار جنسی” خوشایند است. در عوض ، مغز ما به گونه ای تکامل یافته است تا محرک های “مثبت” را به محض تماس با آنها شناسایی کند.(Clay, Allen et al. 2008)
پیش از نیم قرن پیش ، یک کشف بزرگ در علوم اعصاب ، سرنخ مهمی در مورد نحوه پردازش محرکهای لذت بخش توسط مغز را نشان داد. این مطالعه توسط دکتر جیمز اولدز ، هنگام کار تحت نظارت دکتر دونالد او. هب در دانشگاه مک گیل انجام شد.
وی در وهله اول علاقه مند بود که چگونه تحریک الکتریکی مناطق مختلف مغز باعث ایجاد رفتارها میشود. او و همکار وی ، دکتر پیتر میلنر ، پس از قرار دادن یک الکترود تحریکی دو قطبی در هیپوتالاموس جانبی موش، دریافتند که موش یاد می گیرد که برای اعمال مستقیم محرک الکتریکی در این ناحیه ، اهرم را فشار دهد و تحریک الکتریکی را بر جوایز طبیعی مانند غذا ترجیح میدهد.(Koob 2011)
این یافته نشان می دهد که “یک مرکز لذت” یا نقاطی داغ در مغز وجود دارد و فعال شدن طبیعی این مرکز ممکن است مکانیسمی باشد که می تواند از طریق آن بازخورد سریع درباره ارزش مثبت محرک های مختلف محیطی ارائه شود.
سیستم پاداش مغزی[۱] گروهی از ساختارهای عصبی است که مسئول ایجاد انگیزه ، یادگیری (در درجه اول تقویت مثبت و شرطی سازی کلاسیک) و برانگیختن احساسات مثبت است (به عنوان مثال ، شادی ، سرخوشی و نشئه). اصطلاح سیستم پاداش به گروهی از ساختارهای مغزی یا نقاط داغ گفته میشودکه در برابر محرکهای تقویتکننده یا لذت بخش نظیر مواد مخدر و داروهای اعتیاد آور فعال میگردند.
هنگامی که افراد در برابر محرکی لذت بخش قرار میگیرند، مغز شروع به افزایش آزادسازی انتقال دهنده[۲] (پیام آور عصبی) دوپامین میکند و فعالیت مناطق مغزی مرتبط با دوپامین افزایش مییابد. دوپامین هورمون لذت است که در زمان انجام فعالیت های لذت بخش نظیر خندیدن، غذا خوردن، سکس، مصرف الکل و مواد و … آزاد میشود. مسیر دوپامینی مزولیمبیک مهمترین منطقه موجود در مغز است که با با لذت و پاداش مرتبط است.
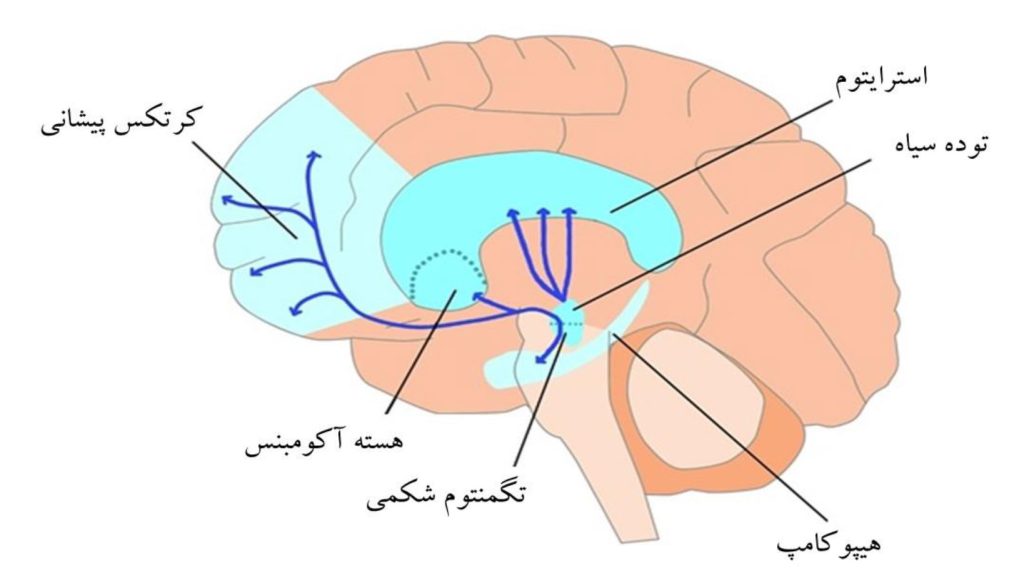
این مسیر ناحیه تگمنتوم شکمی[۳] را به هستههای آکومبنس[۴] متصل میکند و با سایر نواحی مغزی نظیر کرتکس پیشانی (عملیات های شناختی و تصمیم گیری)، هیپوکامپ(عملیات حافظه)، استرایتوم (عملیات حرکتی) و توده سیاه[۵] (عملیات حرکتی) در ارتباط است. سیستم پاداش مغز مسئولیت تحریک (برای مثال «خواستن»، میل و تمایل به پاداش)، یادگیری مشارکتی (در درجهی اول تقویت مثبت و شرطی شدن کلاسیک) و احساس مثبت، به خصوص برای حالتهایی که لذت را به عنوان یک مؤلفه ی اصلی میشناسند (برای مثال شادی، سرخوشی و اشتیاق) را بر عهده دارد(Arias-Carrión, Stamelou et al. 2010)
پاداش یک ویژگی جالب و جذاب از یک محرک است که میتواند یک رفتار اعتیادآور را در فرد القاکند . در بررسی های این موضوع در زمینه علوم اعصاب، محرک مربوط به پاداش را به صورت زیر توصیف کردهاست، ” عبارت از مجموعه عواملی که فراوانی مطلوب را افزایش میدهند و یا هر عامل خوشایند و خشنودکنندهای که نرخ پاسخدهی (انجام رفتار) را در فرد افزایش دهد، پاداش نامیده می شود.” در شرطی سازی عامل[۶] ، محرک پاداش به عنوان یک تقویت کننده مثبت در نظر گرفته میشوند (Cooper, Robison et al. 2017)
پاداشهای اولیه، دستهای از محرکهای پاداش هستند که به بقای موجودات و فرزندان آنهاکمک میکنند و شامل پاداشهای هوموستاتیک (برای مثال غذای خوشمزه) و پاداشهای وابسته به تولید مثل (مانند سکس یا مراقبت والدین) هستند.
پاداشهای اولیه، پاداشهای بی قید و شرطی هستند که برای ما جذاب و تحریککننده هستند زیرا ذاتاً لذت بخش هستند. پاداشهای ثانویه (برای مثال پول یا دیدن برد تیم مورد علاقه) پاداشهای شرطی هستند که منجر به تقویت رفتار میشوند، اما ذاتاً لذت بخش نیستند.
در واقع پاداشهای بیرونی بعد از شرطی سازی با پاداشهای ذاتی احساس لذت را در فرد به وجود آورده اند برای مثال محرک پول به عنوان یک پاداش ثانویه، از توانایی برای برقراری امکانات برای فرزندان که یک پاداش ذاتی میباشد استخراج میشود.(Heffley 2019)
سیستم پاداش مغز شامل چندین سایت و انتقال دهنده عصبی است. در این میان بیشترین مطالعات روی ارتباط بین نورون های دوپامینرژیک (DA) واقع در ناحیه تگمنتال شکمی (VTA) که به هسته اکومبنس (NAc) منتقل می شوند و نقشی اساسی آن در پردازش محرک های مربوط به پاداش ، از جمله مصرف مواد استفاده انجام شده است.
در واقع ، مصرف مواد غیر قانونی ، از طریق اثرات مختلف دارویی ، باعث افزایش ترشح DA در ناحیه پوسته NAc می شوند ، که منجر به افزایش بسیار سریع DA در این ناحیه می شود بنابراین افزایش DA زیاد ناشی از شلیک سلولهای DA مرحله ای برای تحریک گیرنده های D1 (D1R) به عنوان سازو کاری ضروری در NAc شناخته میشود
مسیر مزولیمبیک دوپامین حاوی نقاط داغ در فرایند پاداش است که با اجسام سلولی واقع در مغز میانی VTA آغاز می شود که در انسان ، VTA در زیر تالاموس قرار دارد. در حالی که هر دو VTA و جسم سیاه ، خوشه های متراکمی از سلول های دوپامینرژیک بدن را تشکیل می دهند ، انتقالات VTA عمدتا به ساختارهای قشر لیمبیک و پیش پیشانی منتهی می شود ، در حالی که جسم سیاه به طور عمده به گانگلیون های پایه باز می شود.
نورون های VTA همچنین به صورت موضعی درون VTA برای ایجاد اتصالات به اصطلاح “دندرودندریتیک” و همچنین ایجاد اتصال در پایین ساقه مغز عمل میکنند. این پیش بینی های صعودی هستند که تصور می شود بیشترین تأثیر را در خصوصیات انگیزشی محرک های پاداش دارند.(Trutti, Mulder et al. 2019)
علاوه بر این سیستم های مختلف انتقال دهنده عصبی پروجکشن هایی را به VTA ارسال می کنند و تعدیل فعالیت این منطقه نقش دارند. به طور مثال ورودی کولینرژیک از هسته تگمنتالی pedunculopontine مغز میانی از طریق فعال سازی گیرنده های استیل کولین نیکوتینی مستقر بر روی اجسام سلول VTA ، تحریک عمدهای در این منطقه ایجاد میکند. فعال سازی این گیرنده های نیکوتینی باعث باز شدن کانالهای سدیم در دپلاریزاسیون نورونهای VTA می شود که نقش مهمی در خاصیت اعتیاد آور نیکوتین در اثر مصرف دخانیات دارند.
انتشار گلوتامات و اسید آمینه بوتیریک گاما (GABA) از هر دو پروجکشن دیستال و محلی ، به ترتیب مدولاسیون تحریکی و مهاری بیشتری ایجاد می کند. به صورت کلی سلول های VTA نیز به طور غیر مستقیم توسط مدولاسیون کولینرژیک نیکوتینی تحریک گلوتامات و مهار GABA در منطقه تنظیم می شود. میزان شلیک VTA نیز توسط گیرنده های دوپامین ذاتی تعدیل می شود(Clark, Boileau et al. 2019)
Arias-Carrión, O., M. Stamelou, E. Murillo-Rodríguez, M. Menéndez-González and E. Pöppel (2010). “Dopaminergic reward system: a short integrative review.” International Archives of Medicine ۳(۱): ۲۴.
Clark, L., I. Boileau and M. Zack (2019). “Neuroimaging of reward mechanisms in Gambling disorder: an integrative review.” Molecular psychiatry ۲۴(۵): ۶۷۴-۶۹۳.
Clay, S. W., J. Allen and T. Parran (2008). “A review of addiction.” Postgrad Med ۱۲۰(۲): E01-07.
Cooper, S., A. Robison and M. S. Mazei-Robison (2017). “Reward circuitry in addiction.” Neurotherapeutics ۱۴(۳): ۶۸۷-۶۹۷.
Heffley, W. (2019). “Classical conditioning drives learned reward prediction signals in climbing fibers across the lateral cerebellum.” Elife ۸: e46764.
Koob, G. F. (2011). “Neurobiology of addiction.” Focus ۹(۱): ۵۵-۶۵.
Trutti, A. C., M. J. Mulder, B. Hommel and B. U. Forstmann (2019). “Functional neuroanatomical review of the ventral tegmental area.” NeuroImage ۱۹۱: ۲۵۸-۲۶۸.
[۱] Brain Reward System
[۲] Neurotransmitter
[۳] VTA (Ventral Tegmental Area)
[۴] NAc (Nucleus Acumbans)
[۵] Substantia nigra
[۶] Operant Conditioning
ترجمه: جمعیت خیریه تولد دوباره



